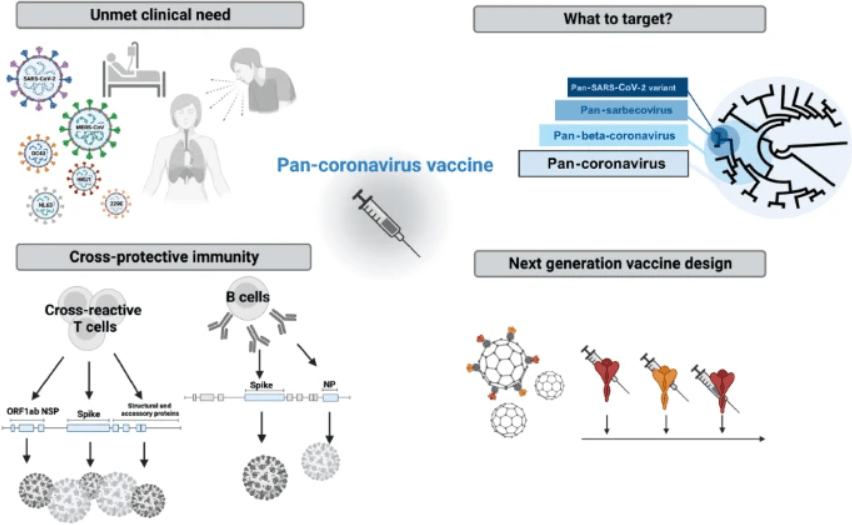
Универсальная — это не одна прививка «от всех вирусов сразу». В практическом смысле речь о трёх уровнях широты: “пан-вариант” (против всех вариантов одного вируса), “пан-подрода” (например, всех сарбековирусов: SARS-CoV-2, SARS-CoV-1 и родственные), и “пан-семейства” (вся семья коронавирусов). Ключ — найти консервативные эпитопы, которые мало меняются и к которым можно «пришить» иммунный ответ. Обзор в Cellular & Molecular Immunology как раз раскладывает эту лестницу целей и подходов.
ИИ здесь ускоряет два узких места:
- вычислительный поиск и ранжирование таких эпитопов (B- и T-клеточных) по огромным базам последовательностей и структур,
- генеративный дизайн белковых носителей/наночастиц и мультивалентных антигенов, чтобы сфокусировать ответ именно на «общих» участках. Современные обзоры фиксируют: от NetMHCpan/MARIA/Vaxign-ML до глубоких сетей и диффузионных моделей (как RFdiffusion) — всё это уже используется в контурах “reverse vaccinology”.
Свежие результаты (лето 2025)
— Пайплайн LJI для универсальных вакцин (T-клеточный фокус). Группа Альбы Грифони в Cell (июль–август 2025) показала, как через Immune Epitope Database и ИИ-методы находить консервативные Т-клеточные эпитопы у бетакоронавирусов. Идея: даже если новая «корона» прорывает нейтрализацию антителами, правильно подобранный Т-клеточный ответ снижает риск тяжёлого течения. Этот же конвейер авторы переносят на другие респираторные вирусы.
— Мозаичные наночастицы для пан-сарбековирусной защиты. В Cell (2025) сравнили варианты «мозаик» с наборами RBD разных сарбековирусов, рассчитанных вычислительно. Кандидат mosaic-7COM у мышей дал более широкие титры связывания/нейтрализации и сместил ответ в сторону консервативных эпитопов — именно того, что нужно «универсальной» стратегии. Это прямой пример, где дизайн опирается на вычисления/ИИ.
— Наномедицина вне коронавирусов. Концепция «квартет-нанокейджей» (Nature Nanotechnology, 2024) демонстрирует, как мультивалентная подача антигенов может раздувать клонов B-клеток, распознающих общее у штаммов. Для ИИ это поле — оптимизация состава/геометрии мозаик и прогноз иммунодоминантности.
Инфлюэнца как полигон
Многошаговые вычислительные подходы к «универсальному» гриппу развиваются параллельно:
— mRNA-«энциклопедия» из 20 HA (Penn): одна формула кодирует гемагглютинины всех подтипов A и линий B, обеспечивая широкий базовый ответ в моделях; клинические шаги идут, но это пока не «готовая универсальная» вакцина.
— COBRA/Еpigraph: алгоритмически оптимизированные антигены для широкой перекрёстной защиты; за последние годы — серия доклинических и ранних клинических работ по H1/H2/H5/H7 и гриппу B. Это не «ИИ» в узком смысле, но та же школа вычислительного дизайна, где ИИ-модели всё чаще подключают к отбору эпитопов.
Эксперты также подчёркивают: mRNA-платформа остаётся самым быстрым способом воплощать такие «мозаики» и быстро обновлять их — и это вероятный маршрут к первым по-настоящему широким вакцинам. Но клиническая «доставка» универсальности ещё впереди.
Что уже умеет ИИ в вакцинологии — и где границы
Факты из свежих систематических обзоров (2024–2025):
— ускоряет эпитопное картирование и многокомпонентный дизайн (мульти-эпитопные/мозаичные антигены),
— помогает в доставке (подбор липидных наночастиц/формуляций),
— оптимизирует производство и «холодовую цепь»,
— поддерживает адаптивные дизайны клинических испытаний и даже мониторинг восприятия вакцинации в популяции.
Ограничения: неоднородные данные, смещения по HLA/этническим выборкам, объяснимость моделей и регуляторные стандарты — без этого «универсальность» может оказаться универсальной не для всех.
Вывод
ИИ действительно ускоряет путь к «широким» и «пан-семейным» вакцинам — от поиска неизменяемых мишеней до конструирования мозаичных иммуногенов и носителей. Уже есть убедительные доклинические демонстрации (mosaic-7COM, нанокейджи; T-клеточный конвейер LJI), но регистрационных универсальных вакцин пока нет: ближайшие годы решат, насколько эти вычислительные стратегии перенесутся из красивых графиков и мышиных моделей в человеческие фазы II–III.


